484億美元。
這是今年上半年,國產(chǎn)創(chuàng)新藥的出海交易總金額。2025年前六個月的表現(xiàn)已接近2024年全年水平,達(dá)到歷史新高。
在中國新能源汽車和人工智能等產(chǎn)業(yè)領(lǐng)域強(qiáng)勢崛起的同時,創(chuàng)新藥也在成為中國在高新技術(shù)領(lǐng)域突破的典型代表。
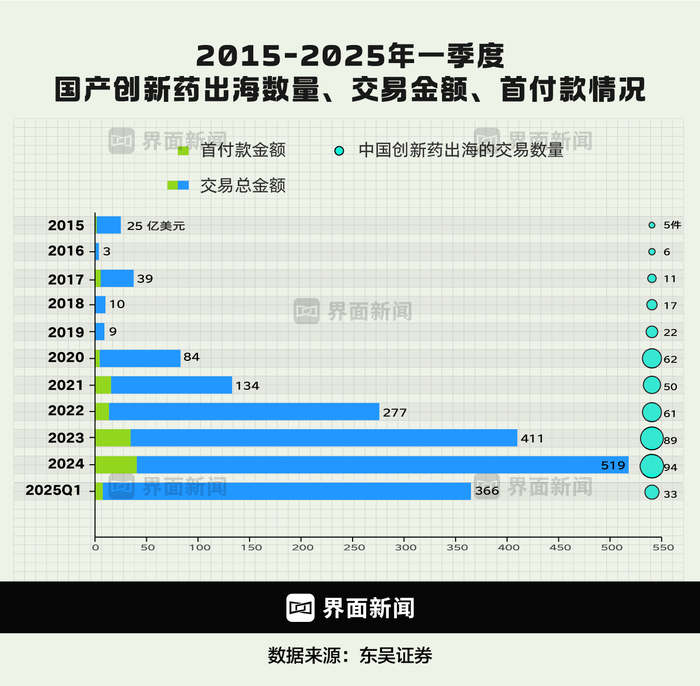 圖為中國創(chuàng)新藥出海交易近10年的變化 制圖:界面新聞 何苗
圖為中國創(chuàng)新藥出海交易近10年的變化 制圖:界面新聞 何苗
與仿制藥研發(fā)壁壘低,價值更在普惠不同,創(chuàng)新藥面對的永遠(yuǎn)是人類生命健康中尚無解法的難題——比如癌癥、罕見病。醫(yī)藥行業(yè)用“十年時間,十億美元”概括其研發(fā)的長周期、高風(fēng)險和高成本。也有人將這個過程比作大把金錢、野心與分子科學(xué)混調(diào)而成的烈酒。
做國產(chǎn)創(chuàng)新藥、甚至帶中國創(chuàng)新藥走向全球,一直是國內(nèi)創(chuàng)新藥行業(yè)的愿景。近半年來,中國醫(yī)藥企業(yè)接連掀起的巨浪正帶著這些夢想慢慢走向現(xiàn)實(shí)。
今年5月,老牌藥企三生制藥以12.5億美元的首付款價格將一款在研雙抗創(chuàng)新藥的海外權(quán)益出售給“宇宙大藥廠”輝瑞,一舉打破了國產(chǎn)創(chuàng)新藥對外授權(quán)交易首付款的最高紀(jì)錄。
除三生制藥外,信達(dá)生物、和鉑醫(yī)藥等也都先后與海外大藥企達(dá)成單筆交易總價超10億美元的對外授權(quán)。
在融資與支付上,7月的第一周,國家醫(yī)保局、國家衛(wèi)健委聯(lián)合印發(fā)《支持創(chuàng)新藥高質(zhì)量發(fā)展的若干措施》,創(chuàng)新藥商保目錄申報箭在弦上。而禾元生物IPO成功過會則意味著,塵封已久的科創(chuàng)板再次對未盈利生物醫(yī)藥公司敞開了大門。
仿佛短短幾個月內(nèi),“創(chuàng)新藥寒冬”已然煙消云散,國產(chǎn)創(chuàng)新藥們迎來了自己的新一波浪潮。
01 最初的夢想
風(fēng)起于青萍之末,中國創(chuàng)新藥進(jìn)入公眾視野是在這半年,而這條路卻已經(jīng)走了20多年。
2002年,瑞士巨頭諾華制藥的白血病藥物伊馬替尼(格列衛(wèi))剛剛在美國獲批,腫瘤靶向治療時代的大幕緩緩拉開。同在這一年,李嘉誠投資的和黃醫(yī)藥也在上海成立,成為國內(nèi)最早從事創(chuàng)新藥研發(fā)的公司之一。它最初的員工包括后來的再鼎醫(yī)藥創(chuàng)始人杜瑩、亞虹醫(yī)藥創(chuàng)始人潘柯。
一年后,留美的丁列明與王印祥回國創(chuàng)立貝達(dá)藥業(yè),研發(fā)埃克替尼,也就是日后中國的首款國產(chǎn)小分子抗癌藥。2009年,曾任美國密歇根大學(xué)副教授的楊大俊在上海創(chuàng)辦了亞盛醫(yī)藥。
這批最早的海歸見證過美國成熟的創(chuàng)新藥行業(yè)如何一步步發(fā)展壯大。但想把大洋彼岸的盛景移植過來絕非易事。彼時國內(nèi)創(chuàng)新藥研發(fā)領(lǐng)域則堪稱鹽堿地。由于新藥定義寬松,審評標(biāo)準(zhǔn)又不透明,遞往藥監(jiān)局的各種審批資料嚴(yán)重積壓,許多公司在遞交申報材料之后就陷入無盡的等待。
混沌初開時期的重大不確定性,讓風(fēng)險投資都對國產(chǎn)創(chuàng)新藥避之不及。貝達(dá)藥業(yè)創(chuàng)始人丁列明曾回憶,研發(fā)埃克替尼時,他一度找不到錢做該藥的III期臨床研究。
變化始于2015年,彼時的原國家食藥監(jiān)局開啟了國內(nèi)一系列藥審改革。創(chuàng)新藥標(biāo)準(zhǔn)開始與國際對齊,鼓勵新藥研發(fā)、加速新藥審批上市。
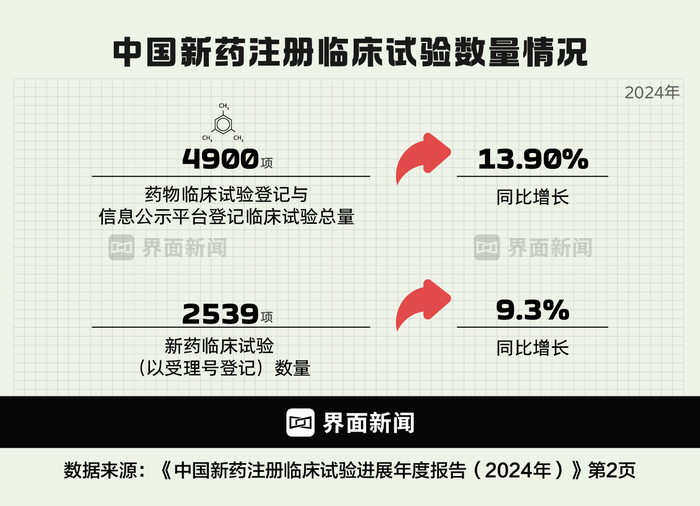 圖為中國創(chuàng)新藥臨床開展情況的近些年變化 制圖:界面新聞 何苗
圖為中國創(chuàng)新藥臨床開展情況的近些年變化 制圖:界面新聞 何苗
如百濟(jì)神州,亞盛醫(yī)藥等最早破土而出的創(chuàng)業(yè)公司逐步走上臺前。
另一方面,當(dāng)時的國家食藥監(jiān)局也著手推進(jìn)仿制藥一致性評價,為日后的帶量采購、控費(fèi)做好鋪墊。帶量采購的出現(xiàn)意味著仿制藥的利潤勢必將薄如刀片,也加速了傳統(tǒng)成熟藥企向研發(fā)創(chuàng)新藥轉(zhuǎn)型。
以仿制藥起家的恒瑞醫(yī)藥在2018年宣布,只做創(chuàng)新藥和有核心價值的高端仿制藥。
資本市場也在發(fā)力,2018年的“港股18A”、2019年的科創(chuàng)板新規(guī),允許未盈利的生物科技公司上市,都給剛蹣跚起步的國內(nèi)創(chuàng)新藥公司直接插上了翅膀。
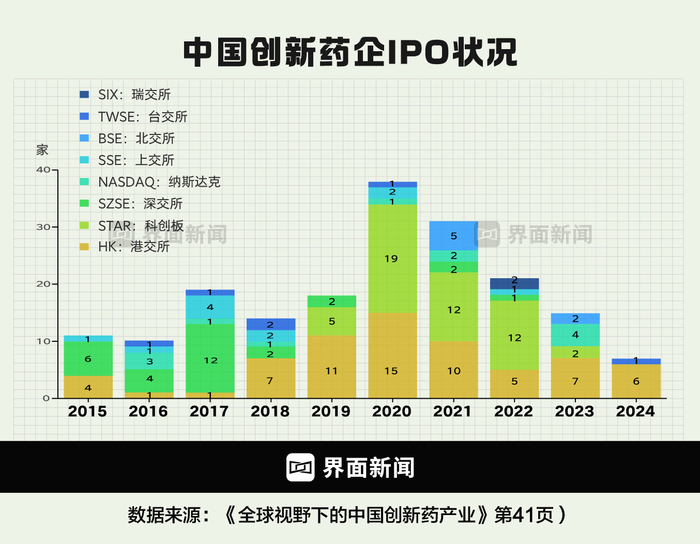 圖為中國創(chuàng)新藥企業(yè)IPO情況 制圖:界面新聞 何苗
圖為中國創(chuàng)新藥企業(yè)IPO情況 制圖:界面新聞 何苗
履歷光鮮的創(chuàng)始團(tuán)隊(duì)加上漂亮的管線圖就能引來投資,開啟天使輪和風(fēng)投并同步遞交招股書仿佛也并非癡人說夢,大量一線知名創(chuàng)新藥企都在這幾年里實(shí)現(xiàn)了IPO。
中國創(chuàng)新藥就在這樣沸騰、熱辣的氣氛下,迎來了第一波浪潮。
02 研發(fā)求變
但是這股浪潮并沒有持續(xù)太久。
當(dāng)時,中國的創(chuàng)新藥公司在立項(xiàng)開發(fā)上多采用跟隨策略,緊盯國外創(chuàng)新藥的研發(fā)進(jìn)展,跟在后面做同類產(chǎn)品。
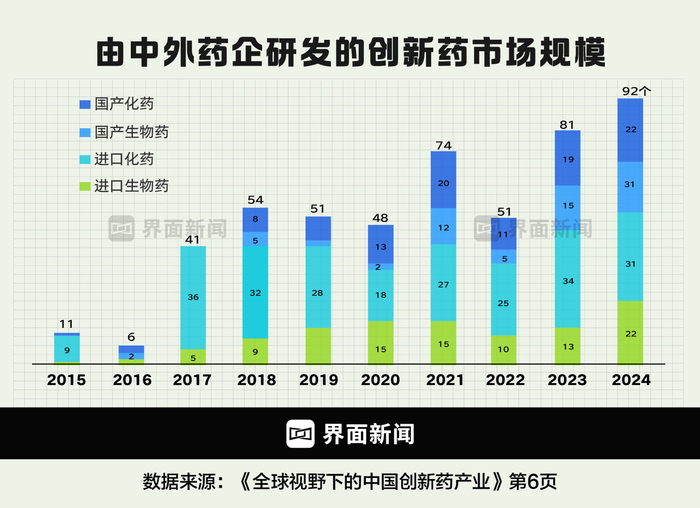 圖為近些年國產(chǎn)和進(jìn)口創(chuàng)新藥獲批數(shù)量 制圖:界面新聞 何苗
圖為近些年國產(chǎn)和進(jìn)口創(chuàng)新藥獲批數(shù)量 制圖:界面新聞 何苗
2014年,默沙東帕博利珠單抗在美國獲批,這款俗稱K藥的PD-1單抗成為癌癥治療史上的里程碑式藥物,并在后來以300億美元的年銷售額成為全球“藥王”。
于是在那幾年,國內(nèi)的PD-1數(shù)量多到被臨床研究者戲稱“足夠用來洗澡”。到2020年,最早上市的四款國產(chǎn)PD-1以降價60%-80%的代價進(jìn)入國家醫(yī)保目錄。同質(zhì)化也導(dǎo)致“價格戰(zhàn)”硝煙四起。
短短兩年時間,千億級國內(nèi)PD-1市場縮水三分之二,只剩下兩三百億。2023年7月,恒生創(chuàng)新藥指數(shù)跌到了歷史最低點(diǎn),相比于2021年7月的頂峰已下跌76%,創(chuàng)新藥行業(yè)由盛夏疾速轉(zhuǎn)入隆冬。
好在故事沒有就此結(jié)束。
研發(fā)出一款新藥像是在酷暑中跑超長程的馬拉松。真正以此為志的人往往不乏超常的韌勁和雄心。
就像亞盛醫(yī)藥創(chuàng)始人楊大俊對界面新聞?wù)f的那樣,作為最早出國、在美國時做最前沿研究、又很早回國的“弄潮兒”,他回國創(chuàng)業(yè)時就定下了要做原始創(chuàng)新的目標(biāo)。
整個產(chǎn)業(yè)也在吸取教訓(xùn)、從最開始的研發(fā)端悄然起變。
2012年,夏瑜等人在廣東中山成立康方生物。這家公司英文名Akeso源自希臘治愈女神。在同行不看好的目光中,康方生物著手研發(fā)兼具廣泛療效又安全的PD-1雙抗。2024年,其一款核心PD-1雙抗藥物在嚴(yán)格比對中首次戰(zhàn)勝默沙東的藥王K藥。
在第一波浪潮的淘汰賽里,那些存活并且順利出海的公司重塑了國內(nèi)創(chuàng)新藥產(chǎn)業(yè)的發(fā)展思路——單純模仿海外產(chǎn)品已不再能輕易拉來投資,更強(qiáng)調(diào)速度和差異化創(chuàng)新。
百濟(jì)神州的澤布替尼和傳奇生物的CAR-T療法西達(dá)基奧侖賽,成為兩個異常耀眼又難得的例子。兩者用于治療不同的血液腫瘤,先后都成功在美國獲批上市。更重要的是,它們分別擊敗了來自國際制藥巨頭強(qiáng)生/艾伯維和百時美施貴寶的同類競品,雙雙被證明具有更優(yōu)異的療效和安全性,成為各自賽道上的同類最優(yōu)藥物。
2023年,百濟(jì)神州的澤布替尼成為首個銷售額超10億美元的國產(chǎn)抗癌藥;傳奇生物的西達(dá)基奧侖賽如今距“十億美元分子”也只差一步之遙。
現(xiàn)任恒瑞醫(yī)藥副總裁、上海恒瑞CEO的賀峰博士向界面新聞回憶,十年前,公司研發(fā)人員很少參加國際學(xué)術(shù)會議,原因很簡單——沒太多需求。而約從4、5年前起,公司開始要求要么做同類最先(FIC,first-in-class)、要么做同類最優(yōu)(BIC,best-in-class)。恒瑞醫(yī)藥每年也組織起龐大的研發(fā)與商務(wù)拓展團(tuán)隊(duì)參與各種國際學(xué)術(shù)會議,來增進(jìn)知識與信息交流,加強(qiáng)創(chuàng)新敏感度。
賀峰對界面新聞介紹,對于同類最優(yōu)項(xiàng)目,早研部門需要盡可能研究透徹同一賽道上的競品,能找到明顯切入點(diǎn)的優(yōu)勢項(xiàng)目才會開題;而其他項(xiàng)目,“不單是早研階段,還要求臨床階段,都要保證是全球前列”。
03 重塑“中國信譽(yù)”
當(dāng)然,同類最先和同類最優(yōu)沒有一個好做,都是難啃的硬骨頭。
前者沒有先例能參考,海內(nèi)外從先驅(qū)做成先烈的公司不在少數(shù);后者挑戰(zhàn)的則是先行者已充分研究但依舊無法解決的軟肋。
做創(chuàng)新藥的特殊之處在于,制藥人得與難以捉摸的大自然和生命體交手。確定性只能逐漸地來自于足夠多且可靠的臨床數(shù)據(jù),并一直到理想中的新藥真正被成功開發(fā)出來。
在蘇州宜聯(lián)生物創(chuàng)始人、董事長兼CEO薛彤彤看來,如今國產(chǎn)創(chuàng)新藥變成寵兒、密集出現(xiàn)更大額的出海授權(quán),中國創(chuàng)新藥行業(yè)在過去5年里共同完成的工作便是積累臨床數(shù)據(jù)和海外信譽(yù),最終得以證明自身價值。
 圖為宜聯(lián)生物研發(fā)部門 圖片來源:宜聯(lián)生物
圖為宜聯(lián)生物研發(fā)部門 圖片來源:宜聯(lián)生物
據(jù)摩熵醫(yī)藥中國臨床試驗(yàn)數(shù)據(jù)庫,2019年至2024年,中國臨床試驗(yàn)登記總量由2385項(xiàng)提升至4884項(xiàng),年復(fù)合增長率達(dá)15%,其中新藥研發(fā)占比過半。
賀峰告訴界面新聞,在今年6月剛剛結(jié)束的美國臨床腫瘤學(xué)會(ASCO)上,來自中國創(chuàng)新藥的口頭報告都占據(jù)了三分之一。
ASCO是全球規(guī)模最大、級別最高的腫瘤學(xué)術(shù)會議之一。今年,恒瑞醫(yī)藥以口頭報告的形式分享了一項(xiàng)關(guān)于乳腺癌創(chuàng)新藥達(dá)爾西利輔助治療的研究。參與該研究的患者近6000名之多。來自全世界的行業(yè)專家在ASCO現(xiàn)場共同聆聽了這項(xiàng)大型臨床研究的試驗(yàn)設(shè)計(jì)與極佳的陽性結(jié)果。
也正是在一次次曝光中,海外過去對中國創(chuàng)新藥公司及其臨床數(shù)據(jù)質(zhì)量的遲疑也逐漸消散。
早在2015年7月22日,原國家食藥監(jiān)局曾要求展開藥物臨床試驗(yàn)數(shù)據(jù)自查核查。在這一“史上最嚴(yán)數(shù)據(jù)核查要求”下,八成申報企業(yè)主動撤回了申報材料。該事一度被業(yè)內(nèi)稱為“722慘案”。
2016年,澳大利亞記者將前述情況誤稱為“80%的中國臨床數(shù)據(jù)造假”,這一表述又被二次引用,極大損害了中國在相關(guān)領(lǐng)域的國際聲譽(yù)。盡管此后中國藥監(jiān)機(jī)構(gòu)持續(xù)出臺政策,確保國內(nèi)藥企臨床試驗(yàn)數(shù)據(jù)的準(zhǔn)確性,但已經(jīng)形成的對外印象不會輕易消失。
在2023年ASCO會議上,百利天恒的雙抗ADC(抗體偶聯(lián)藥物) BL-B01D1憑優(yōu)異的國內(nèi)臨床數(shù)據(jù)吸引到一眾跨國藥企的目光,但也沒躲過在數(shù)據(jù)可靠性方面的疑慮。
百利天恒董事長朱義告訴界面新聞,得益于這款藥的美國買方百時美施貴寶的充分盡調(diào),海外同行對中國數(shù)據(jù)的疑慮最終得以打消。
 圖為百利天恒董事長朱義 圖片來源:百利天恒
圖為百利天恒董事長朱義 圖片來源:百利天恒
盡調(diào)期間,百時美施貴寶派出第三方前往中國的臨床試驗(yàn)機(jī)構(gòu)拷貝腫瘤原始影像,重新評估研究結(jié)論;又前往百利天恒在成都的工廠和研發(fā)中心,核查BL-B01D1工藝發(fā)展過程中的邏輯性、數(shù)據(jù)堅(jiān)實(shí)性。
唯一直接獲得百時美施貴寶全權(quán)信任的數(shù)據(jù)來自公司位于美國的創(chuàng)新藥研發(fā)中心“西雅圖免疫”。
這是百利天恒早在2014年就設(shè)立、借美國本土創(chuàng)新生態(tài)做原始創(chuàng)新的地方,負(fù)責(zé)的是BL-B01D1的臨床前早期研究部分。“西雅圖免疫提供的數(shù)據(jù)說什么他們(百時美施貴寶)就認(rèn)什么,就只有不清晰的地方還要再問問,僅此而已,連那地方都沒去。”朱義對界面新聞?wù)f。
好在每一處都經(jīng)受住了考驗(yàn)。2023年12月,百利天恒與百時美施貴寶對外披露了的合作消息,BL-B01D1創(chuàng)下84億美元交易總價記錄,此后又在同類分子中率先完成全球首個III期臨床研究。
與百時美施貴寶達(dá)成合作后,雙方共同討論對利益相關(guān)方的披露口徑,寫在第一條的便是“該交易是基于一項(xiàng)超800名患者的大樣本量數(shù)據(jù)”。在朱義看來,這是百時美施貴寶對公司研發(fā)水平和資產(chǎn)質(zhì)量的認(rèn)可。
幸而走過的“自證”之路并無白費(fèi)。朱義感覺到此后跨國藥企們看百利天恒的在研項(xiàng)目數(shù)據(jù)時,已不再擔(dān)心臨床試驗(yàn)數(shù)據(jù)的質(zhì)量。
作為國內(nèi)較早開啟國際化戰(zhàn)略的公司,復(fù)宏漢霖也在與跨國藥企的合作中逐步獲得信任。
公司首席商務(wù)發(fā)展官、高級副總裁曹平回憶,2022年,復(fù)宏漢霖與美國歐加隆共同創(chuàng)造了一筆生物類似藥領(lǐng)域近6年來的最大合作。但當(dāng)時新冠疫情突襲,歐加隆曾一度擔(dān)憂復(fù)宏漢霖作為中國企業(yè)的交付保障,直到公司以高效的執(zhí)行力和實(shí)際行動兌現(xiàn)了承諾。
04 等待“重磅炸彈”
2025年的前5個月中,在全球首付款大于5000萬美元規(guī)模的商務(wù)拓展交易中,中國占比已經(jīng)從2021年的5%提升至42%。
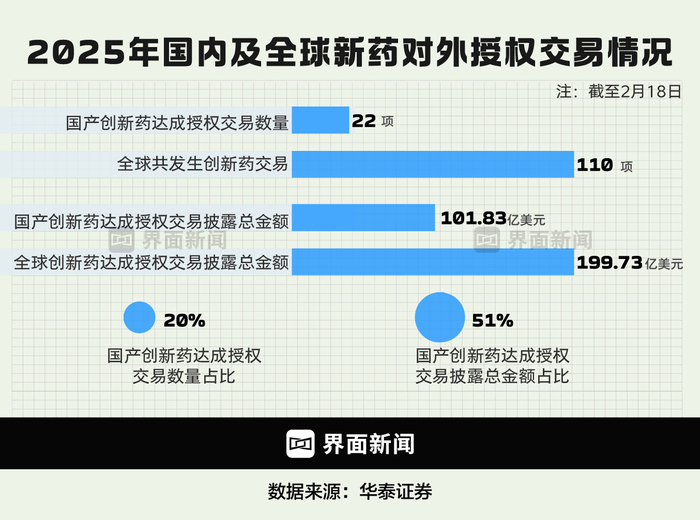 圖為中國創(chuàng)新藥年初交易情況 制圖:界面新聞 何苗
圖為中國創(chuàng)新藥年初交易情況 制圖:界面新聞 何苗
而當(dāng)手上的產(chǎn)品更具競爭力,國內(nèi)創(chuàng)新藥企們也已開始不滿足于僅僅將新藥授權(quán)出去。進(jìn)化成為國際化公司,親自開發(fā)、銷售自己的新藥成為一些人最終的目標(biāo)。
只不過無論什么行業(yè),進(jìn)入每一個新市場要遵守和適應(yīng)當(dāng)?shù)氐谋O(jiān)管規(guī)定和商業(yè)環(huán)境。更何況做出一款創(chuàng)新藥的過程堪稱冗長,完成這一鏈條成為任何人都無法獨(dú)自實(shí)現(xiàn)的壯舉。
薛彤彤向界面新聞分析,這讓如今的中國創(chuàng)新藥公司去找海外合作伙伴幾乎成為一條必然選擇,并同時能獲得現(xiàn)金回報、打響公司品牌,來實(shí)現(xiàn)資產(chǎn)價值。
而對意在構(gòu)建全球體系的國內(nèi)創(chuàng)新藥公司來說,現(xiàn)金回報甚至不是唯一首要的。
百利天恒找合作者時,朱義始終堅(jiān)持不做買斷性交易,而要共享BL-B01D1在海外的開發(fā)和收益權(quán)。公司也直言希望借與百時美施貴寶的合作,促進(jìn)其建立起在全球的臨床開發(fā)和商業(yè)化能力。
這背后的原因是,神槍手都是靠子彈喂出來的。而與海外大廠的洽談和合作就是一次次射擊練習(xí)。
賀峰向界面新聞舉例,海外跨國藥企對產(chǎn)品的要求非常高,在調(diào)研評估潛在產(chǎn)品時,它們會有多輪既雜又細(xì)的問題。從發(fā)現(xiàn)研究、臨床研究,到工藝生產(chǎn),每個環(huán)節(jié)回答的問題加起來有成百上千。而在梳理思路和回答問題的過程中,中國藥企實(shí)際上可以了解并學(xué)習(xí)到海外跨國藥企在各個環(huán)節(jié)的認(rèn)知、把控與經(jīng)驗(yàn)。
年輕的宜聯(lián)生物同樣如此成長。初期,其與國內(nèi)的創(chuàng)新藥公司廣泛合作,由此獲得利潤,也驗(yàn)證技術(shù)、積累數(shù)據(jù)和競爭力。成立三年后,公司的授權(quán)對象則擴(kuò)展到在美股上市的再鼎醫(yī)藥和BioNtech。
前者讓宜聯(lián)生物第一次拿到了海外的資金——這是國內(nèi)公司給不了的價格;后者的建議則幫公司在CMC(化學(xué)、制造、控制)環(huán)節(jié)和臨床研究中持續(xù)提升 。
在薛彤彤看來,有資金回籠、有合作伙伴、有學(xué)習(xí)過程,中國藥企才能逐漸積累起國際化的體系和經(jīng)驗(yàn),在海外推進(jìn)創(chuàng)新藥管線,直到真正靠自己做完國際III期臨床、遞交上市申請。而再往后,企業(yè)又將面臨商業(yè)化上的問題,即使這個環(huán)節(jié)仍將交給合作伙伴,但這一過程中,中國藥企的分配權(quán)無疑將越來越大。
而這樣的設(shè)想在百利天恒身上已開始體現(xiàn)。
朱義告訴界面新聞,公司計(jì)劃在2025年到2030年這五年形成跨國藥企的框架,包括在國內(nèi)外具備早期研發(fā)、臨床開發(fā)、商業(yè)化、生產(chǎn)四方面的能力。
7月2日深夜,半年沒更新朋友圈的朱義接連轉(zhuǎn)發(fā)四條動態(tài),內(nèi)容都是BL-B01D1治療鼻咽癌的III期臨床試驗(yàn)在期中分析達(dá)到主要終點(diǎn)的消息。這意味著,計(jì)劃中的5年里,百利天恒距離成為跨國藥企的目標(biāo)又進(jìn)了一步。
對于目前的出海熱潮,曹平對其的評價為“這是一個令人興奮的時代”。但她也同時提示,興奮之余還是要看后續(xù)。
曹平認(rèn)為,就目前而言,藥企間大量的合作發(fā)生在了早期資產(chǎn)上,但創(chuàng)新藥領(lǐng)域具有較強(qiáng)的不確定性——產(chǎn)品后續(xù)能否進(jìn)臨床、能否在海外獲批上市、能否成就百億美元銷售額都是未知。
她認(rèn)為,只有當(dāng)中國公司原研開發(fā)的創(chuàng)新藥躋身全球“重磅炸彈”行列,才標(biāo)志著中國創(chuàng)新藥真正進(jìn)入一個輝煌的時代。